A ANVISA, órgão responsável por aprovar os medicamentos no País, concedeu no dia 23 deste mês, o registro do primeiro genérico para prevenção da infecção pelo vírus HIV fabricado no Brasil. O remédio, composto por duas drogas – entricitabina e tenofovir – foi desenvolvido pela indústria farmacêutica brasileira Blanver e, quando tomado diariamente, pode ser mais um elemento para redução das chances de se contrair a doença. A fórmula bloqueia a ação das enzimas que permitem ao RNA se replicar nas células hospedeiras, reduzindo a carga viral no corpo do paciente.
O genérico está previsto para ser distribuído pelo Sistema Único de Saúde (SUS), a partir do segundo semestre, por meio de uma Parceria de Desenvolvimento Produtivo (PDP) já aprovada. A Blanver irá transferir a tecnologia e o conhecimento para a produção do remédio ao Instituto de Tecnologia em Fármacos (Farmanguinhos), braço da Fundação Osvaldo Cruz (Fiocruz). E, também, prevê disponibilizar o medicamento para venda em canais privados.
“A Blanver é uma empresa nacional que sempre se norteou pela qualidade e inovação, e que viabilizará a produção e distribuição no Brasil de um medicamento importante para ajudar no combate de novas incidências da doença, a um custo mais acessível”, explica Sérgio Frangioni, CEO da Blanver.
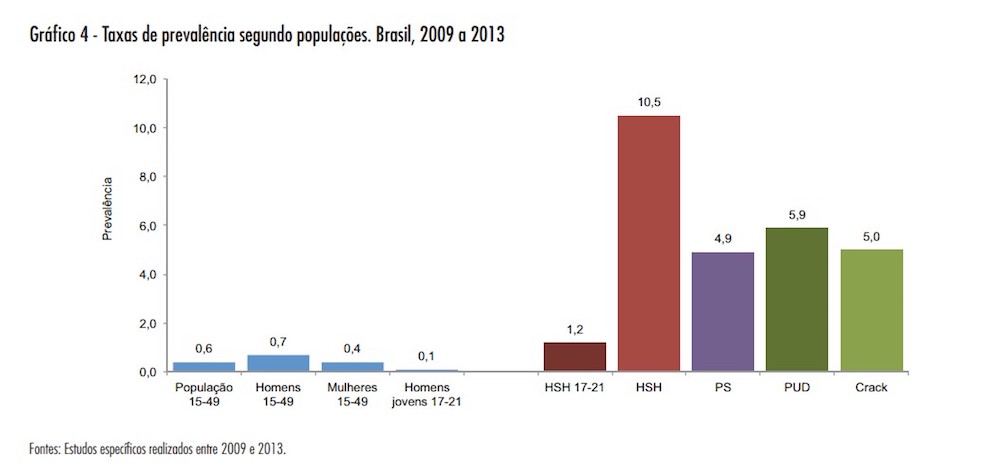
Inicialmente o genérico será direcionado, principalmente, aos cidadãos que estão em grupos de risco. De acordo com o Ministério da Saúde, as maiores incidências da doença estão entre homens que fazem sexo com homens (10,5%) e usuários de drogas (5,9%).
HSH – Homens que fazem sexo com homens
PS – Mulheres profissionais do sexo
PUD – usuários de droga
Crack – usuários de crack
Histórico
A priori, o medicamento de referência era usado apenas para compor esquemas antirretrovirais para tratamento de pessoas que já tinham a doença. Porém, desde 2012, os Estados Unidos liberaram a fórmula para prevenção da infecção em quem não tem a doença. Nesta época, a farmacêutica Blanver foi pioneira e começou a desenvolver o genérico da formulação para o Brasil. Esta estratégia de prevenção também passou a ser vista pelo Ministério da Saúde brasileiro como um caminho para diminuir o número de novos registros. De acordo com o órgão, o País registra, em média, 40 mil novos casos da doença por ano.
O remédio genérico da Blanver também vai ao encontro da meta 90-90-90 estabelecida pela UNAIDs, a agência da ONU para assuntos relacionados à AIDS. A ação prevê que, até 2020, 90% das pessoas vivendo com HIV sejam diagnosticadas. Dentre o total de pessoas diagnosticadas, a expectativa é que 90% passem a usar os medicamentos, para que 90% dos pacientes que estiverem em tratamento comecem a apresentar carga viral indetectável, ou seja, quando o vírus já está em pequena quantidade no organismo.
MINI-BULA
200 mg entricitabina +
300 mg fumarato de tenofovir desoproxila
Blanver Farmoquímica e Farmacêutica S.A.
Comprimidos Revestidos
USO ORAL. USO ADULTO
Frascos com 30 comprimidos revestidos (contendo dessecante). cada comprimido revestido contém 200 mg de entricitabina e 300 mg de fumarato de tenofovir desoproxila (equivalente a 245 mg de tenofovir desoproxila).
INDICAÇÕES: Tratamento da infecção pelo HIV-1 e Profilaxia Pré-Exposição
CONTRAINDICAÇÕES: é contraindicado para pacientes com hipersensibilidade conhecida a qualquer um dos seus componentes
ADVERTÊNCIAS E PRECAUÇÕES: Acidose Láctica e Hepatomegalia Grave com Esteatose, Infecção pelo VHB, Nova Incidência ou Agravamento de Insuficiência Renal, Síndrome da Reconstituição Imune, Falha Virológica Precoce. Usar entricitabina + fumarato de tenofovir desoproxila para reduzir o risco de adquirir HIV-1 somente em indivíduos comprovadamente HIV negativos. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação do médico ou cirurgião- dentista. O medicamento entricitabina + fumarato de tenofovir desoproxila não possui segurança e eficácia comprovadas como intervenção a casais sorodiscordantes para o HIV-1 que possuem o desejo de engravidar. Este medicamento é contraindicado durante a amamentação devido ao risco de reações adversas ao lactente. Se não houver tratamento alternativo, a amamentação e a doação de leite materno deverão ser interrompidos.
TODO O MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DE CRIANÇAS.
REAÇÕES ADVERSAS: acidose lática e hepatomegalia grave com esteatose, exacerbações graves e agudas da hepatite B, nova incidência ou agravamento de insuficiência renal, efeitos ósseos do fumarato de tenofovir desoproxila, Síndrome da reconstituição imune, cefaleia, tonturas e elevação da creatinoquinase.
VENDA SOB PRESCRIÇÃO MÉDICA OU USO SOB PRESCRIÇÃO MÉDICA – PROIBIDA A VENDA.
Atenção – O uso incorreto pode causar resistência ao vírus da AIDS e falha no tratamento.
Reg. M.S. 1.1524.0004
Farm. Resp.: Dr. Adriano Costa Leite – CRF-SP Nº 38.716
Blanver Farmoquímica e Farmacêutica S.A.
SAC 0800-892-2166
Indústria Brasileira
Sobre a Blanver
A Blanver foi fundada em 1984 pelo engenheiro Giuseppe Frangioni, que iniciou a fabricação de excipientes na América Latina, como são chamadas as substâncias inertes funcionais usadas na fabricação de medicamentos e alimentos. Ao longo dos anos, a companhia diversificou a atuação e hoje também produz IFAs e medicamentos.
Considerada uma das três maiores produtoras de excipientes do mundo, a Blanver faz parte de um seleto grupo de laboratórios que firmou parceria para o desenvolvimento produtivo com o Ministério da Saúde para produção e distribuição de medicamentos aos pacientes do SUS (Sistema Único de Saúde). O Tenofovir e o 2 em 1 (Tenofovir + Lamivudina), ministrados no tratamento de pacientes com HIV, são alguns exemplos.
Em janeiro de 2016, a Blanver adquiriu a CYG Biotech, empresa que atua na produção de IFAS (Ingredientes Farmacêuticos Ativos), matérias-primas utilizadas na fabricação de medicamentos. Com a aquisição, o grupo Blanver passou a contar com cerca de 600 colaboradores.
A empresa está presente no estado de São Paulo com três unidades fabris, uma na cidade de Itapevi, fábrica de excipientes, outra em Taboão da Serra, fábrica de medicamento e a terceira em Indaiatuba, destinada a fabricação de IFAs. A Blanver ainda possui unidades comerciais localizadas fora do Brasil, uma na Flórida (EUA) e outra em Barcelona (Espanha). Além de 4 centros de distribuição nos Estados Unidos.
Site: www.blanver.com.br
Facebook: http://www.facebook.com/
Linkedin: http://www.linkedin.com/